原子,元素 素粒子 電子スピン 同素体, 同位体 酸化還元反応 反応熱 金属のイオン化傾向 活性化エネルギー 分極と,過電圧,OCV,CCV ボルタ電池, ダニエル電池 鉛電池 リチウムイオン電池 アレニウスの式 アルコールとエタノール レアアース,レアメタル,貴金属 ウラン, プルトニウム 核分裂, 核融合 放射性炭素年代測定法 ハーバー・ボッシュ法
・In English 鉛電池 標準電極電位 アレニウスの式 分極
■リチウムイオン電池とは
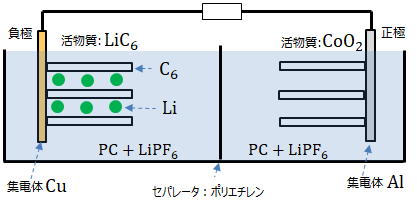
リチウムイオン電池(LIB)は以下の構成になっており、プロピレンカーボネート(PC)等の溶媒にLiPF6 等のリチウム塩が溶解した電解液を使用。
負極の活物質にLiC6 (Liがグラファイトに覆われたもの)、集電体にCu。正極の活物質にCoO2 、集電体にAlの電極が浸っております。
セパレータは正極と負極の短絡による発火を防ぐ役割を持っている絶縁体です。Liを通すことが可能な穴が空いています。
<LFP電池(リン酸鉄リチウムイオン電池)とは>
LFP電池とは、正極材料にリン(P)・鉄(Fe)・リチウム(Li)を用いたリチウムイオン電池のこと。従来のリチウムイオン電池に対して、レアメタルであるコバルトを使わないため安価で、安全性が高く(本体に異物が刺さってもショートしにくい)、劣化しにくい特徴を持っているため、非常に注目されている電池です。
■リチウムイオン電池の基本原理
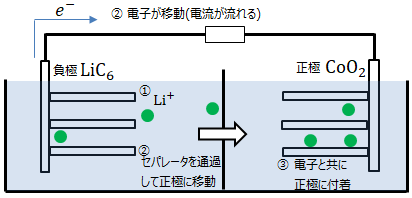
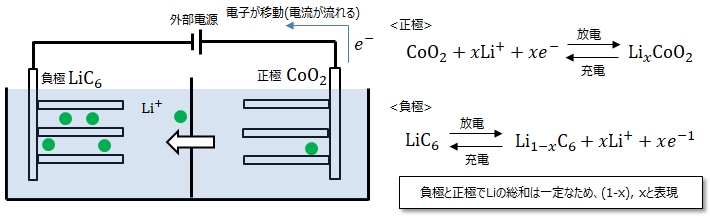
<放電> 酸化還元反応 )<充電> ボルタ電池, ダニエル電池 は充電はできず1次電池といいますが、鉛電池 やリチウムイオン電池の様に充電可能な電池を2次電池 といいます。<起電力> 6 とLiCoO2 の標準電極電位 から求める事ができます。LiC6 は-2.9V、LiCoO2 は0.9Vなので両者の差分の3.8V が起電力となります。
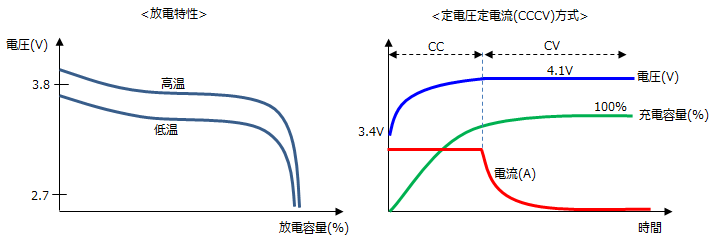
■充放電特性
<温度による影響> 分極 が進んでいることを意味しており、その状態で電流を多く流すと温度が上昇し、劣化や火災が発生しますので、それを防ぐようにしております。<過充電、過放電による影響>
■バッテリー発熱の要因
バッテリーを充放電させる際に発生する熱の要因は、主にエントロピー発熱と分極発熱があります。<分極発熱> 分極 によって電池の内部抵抗の増加による熱損失分の発熱の事をいいます。内部抵抗の変動要因には、温度とバッテリー容量(SOC)があります。
放電すると内部抵抗分だけ発熱しますが、発熱すると内部抵抗は小さくなるのでその分発熱量は抑えられます。また充電時はSOCが高くなるに従い内部抵抗は増加しますが、放電時はSOCが低くなるに従い内部抵抗は増加します。<エントロピー発熱>
■劣化の原因
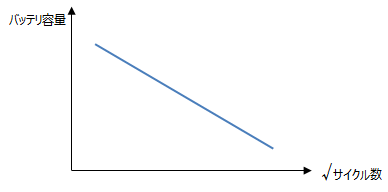
劣化には以下の様な形態があります。<保存劣化> アレニウスの式 によって表すことができ、10℃温度が上昇すると劣化速度が2倍になると言われています。<サイクル劣化> ルート則 といい、バッテリ容量は充放電サイクル数のルート(平方根)に比例するというものです。
サブチャンネルあります。⇒ 何かのお役に立てればと
原子,元素 素粒子 電子スピン 同素体, 同位体 酸化還元反応 反応熱 金属のイオン化傾向 活性化エネルギー 分極と,過電圧,OCV,CCV ボルタ電池, ダニエル電池 鉛電池 リチウムイオン電池 アレニウスの式 アルコールとエタノール レアアース,レアメタル,貴金属 ウラン, プルトニウム 核分裂, 核融合 放射性炭素年代測定法 ハーバー・ボッシュ法