 原子,元素 原子,元素
 素粒子 素粒子
 電子スピン 電子スピン
 同素体, 同位体 同素体, 同位体
 酸化還元反応 酸化還元反応
 反応熱 反応熱
 金属のイオン化傾向 金属のイオン化傾向
 活性化エネルギー 活性化エネルギー
 分極と,過電圧,OCV,CCV 分極と,過電圧,OCV,CCV
 ボルタ電池, ダニエル電池 ボルタ電池, ダニエル電池
 鉛電池 鉛電池
 リチウムイオン電池 リチウムイオン電池
 アレニウスの式 アレニウスの式
 アルコールとエタノール アルコールとエタノール
 レアアース,レアメタル,貴金属 レアアース,レアメタル,貴金属
 ウラン, プルトニウム ウラン, プルトニウム
 核分裂, 核融合 核分裂, 核融合
 放射性炭素年代測定法 放射性炭素年代測定法
 ハーバー・ボッシュ法 ハーバー・ボッシュ法
|
| 公開日:2020/12/29 , 最終更新日:2025/9/13
|
前提知識
■元素、原子とは
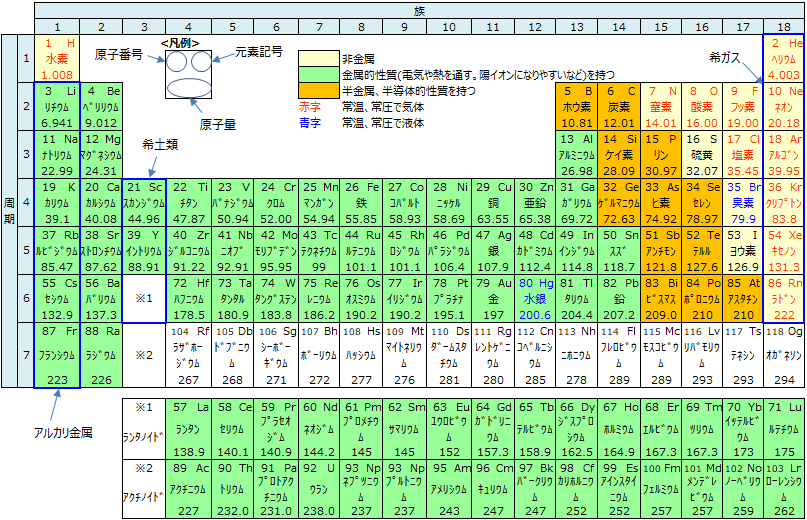
元素とは物質を構成する基本的な成分のことで、以下元素周期表に示されるだけの元素が見つかっています。
元素と原子の違いは、元素は物質の種類を表し、原子は主に物質の数に注目しています。例えば、"元素の数"というと種類数を指すのに対し、"原子の数"というと個数を指します。
原子番号という用語も、これは陽子の個数と等しいため"元素番号"ではなく"原子番号"が適切です。
■余談①
原子番号113のニホニウムは2004年に日本で発見された元素です。私が高校生の頃(約20年前)はニホニウムは無かったので、
その頃の元素周期表はどうなっていたのかと当時の教科書を見てみましたが、なんと、原子番号104以降が全て載っておりませんでした。
理由を調べたところ、実は当時は104番以降はまだ発見されていないのも多かったという事が解りました。
ちなみにニホニウムと命名される前(発見前から存在の可能性があると解っていた)はウンウントリウムといいます。
■原子の構造
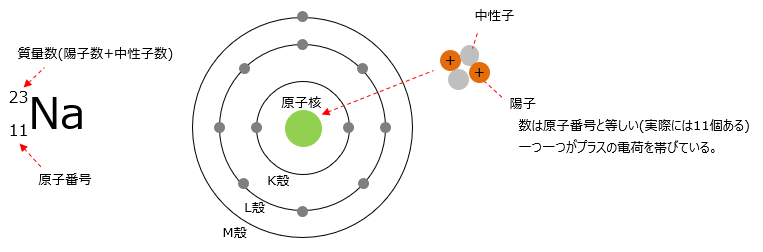
原子の構造は以下の様に、原子核とその周りを動く電子によって構成されます。原子核は更に陽子と中性子で構成され、陽子の数一つ一つがプラスの電荷を帯びています。
陽子の数=原子番号となります。陽子の数+中性子の数=質量数となります。
<電子殻>
電子はマイナスの電荷を帯びており、陽子と同じ数だけあります。原子全体では電荷は帯びてないです。
K殻、L殻、M殻という電子の軌道上に存在できる電子の数が決まっており、K殻は2個、L殻は8個、M殻は18個、N殻は32個と、2n2で増えていきます。
<電子軌道>
電子殻に存在する電子は、すべて同じ平面上に並んでいるわけではなく、原子核を中心として異なる形状の「電子軌道」に分布し、s軌道、p軌道、d軌道・・・ に分類されます。
各種類の軌道には最大数があり、s軌道は1つ、p軌道は3つ、d軌道は5つまで存在します。また、1つの軌道には最大2個の電子が入ります。従って、
・ K殻(n=1)には s軌道が1つ = 計2つの電子
・ L殻(n=2)には s軌道が1つ、 p軌道が3つ = 計8つの電子
・ M殻(n=3)には s軌道が1つ、p軌道が3つ、d軌道が5つ = 計18の電子
となります。
■質量数と原子量の違い
先述したとおり、質量数は陽子数と中性子数の和のため必ず整数を取りますが、ほとんどの原子量は小数点を持っています。
質量数と原子量の違いは、原子は、陽子の数は同じでも中性子の数が異なる同位体を持っており、所定の空間に存在する同位体の比率を考慮して計算した質量が原子量となります。
なお、原子が6.02*1023個集まった時の質量は、その原子の質量数と一致し、それを1molと定義します。この6.02*1023をアボガドロ定数といいます。
サブチャンネルあります。⇒ 何かのお役に立てればと
 原子,元素 原子,元素
 素粒子 素粒子
 電子スピン 電子スピン
 同素体, 同位体 同素体, 同位体
 酸化還元反応 酸化還元反応
 反応熱 反応熱
 金属のイオン化傾向 金属のイオン化傾向
 活性化エネルギー 活性化エネルギー
 分極と,過電圧,OCV,CCV 分極と,過電圧,OCV,CCV
 ボルタ電池, ダニエル電池 ボルタ電池, ダニエル電池
 鉛電池 鉛電池
 リチウムイオン電池 リチウムイオン電池
 アレニウスの式 アレニウスの式
 アルコールとエタノール アルコールとエタノール
 レアアース,レアメタル,貴金属 レアアース,レアメタル,貴金属
 ウラン, プルトニウム ウラン, プルトニウム
 核分裂, 核融合 核分裂, 核融合
 放射性炭素年代測定法 放射性炭素年代測定法
 ハーバー・ボッシュ法 ハーバー・ボッシュ法
|
|
|

