同位体、同素体の違い |
|||||||
|
前提知識
■同位体とは
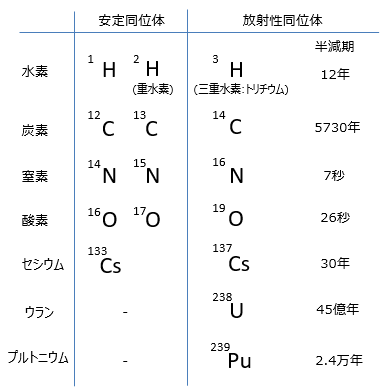
同位体とは、同一の原子番号(陽子数が同じ)だが中性子数が異なる元素同士のこと。アイソトープ、同位元素ともいう。
化学的性質はほぼ同じですが物理的性質は異なります。同位体の例として、水素、炭素、窒素、酸素、セシウム、ウランなどがあります。 <放射性同位体とは>
同位体には安定同位体と放射性同位体があり、中性子の数が安定同位体と異なる数の中性子の場合、不安定な状態にあるため、
中性子を変化させて安定同位体になろうとします。その過程で放出するのが放射線で、その様な同位体のことを放射性同位体(アイソトープ)といいます。 ■同素体とは
同素体とは、同一の元素から構成されるが性質や構造の異なるもの同士のこと。同素体は以下4種類しかありません。
S:斜方硫黄、単斜硫黄、ゴム状硫黄
スコップ(SCOP)と覚えればよいです。
サブチャンネルあります。⇒ 何かのお役に立てればと
|
|
|||||